☆答えはこちら→溶解平衡(溶解度積)の計算(問題と答え) ※原子量:Ag=108, Cl=355 ①ある温度での塩化銀の溶解度積は、Ag Cl –=81×1011 (mol/L) 2 である。 1)この温度では、塩化銀は水1Lに何g溶けるか。純粋に対する塩化鉛(Ⅱ)PbCl 2 の溶解度は、15℃で30×103 mol/Lである。慣れていないと、問題の意味がすでにわからないかもしれません。ここでの溶解度は、溶媒100gあたりに溶ける質量を表す狭義の溶解度ではなく、広い意味での溶解度のことです。 塩化鉛 (II)の溶解度曲線 0°C 25°C 50°C 75°C 100°C 0 g 2 g 4 g 6 g 8 g 10 g 温度 Temperature 溶解度 Solubility 温度 Temperature 水への溶解度 Solubility in H2O エタノールへの溶解度 Solubility in EtOH
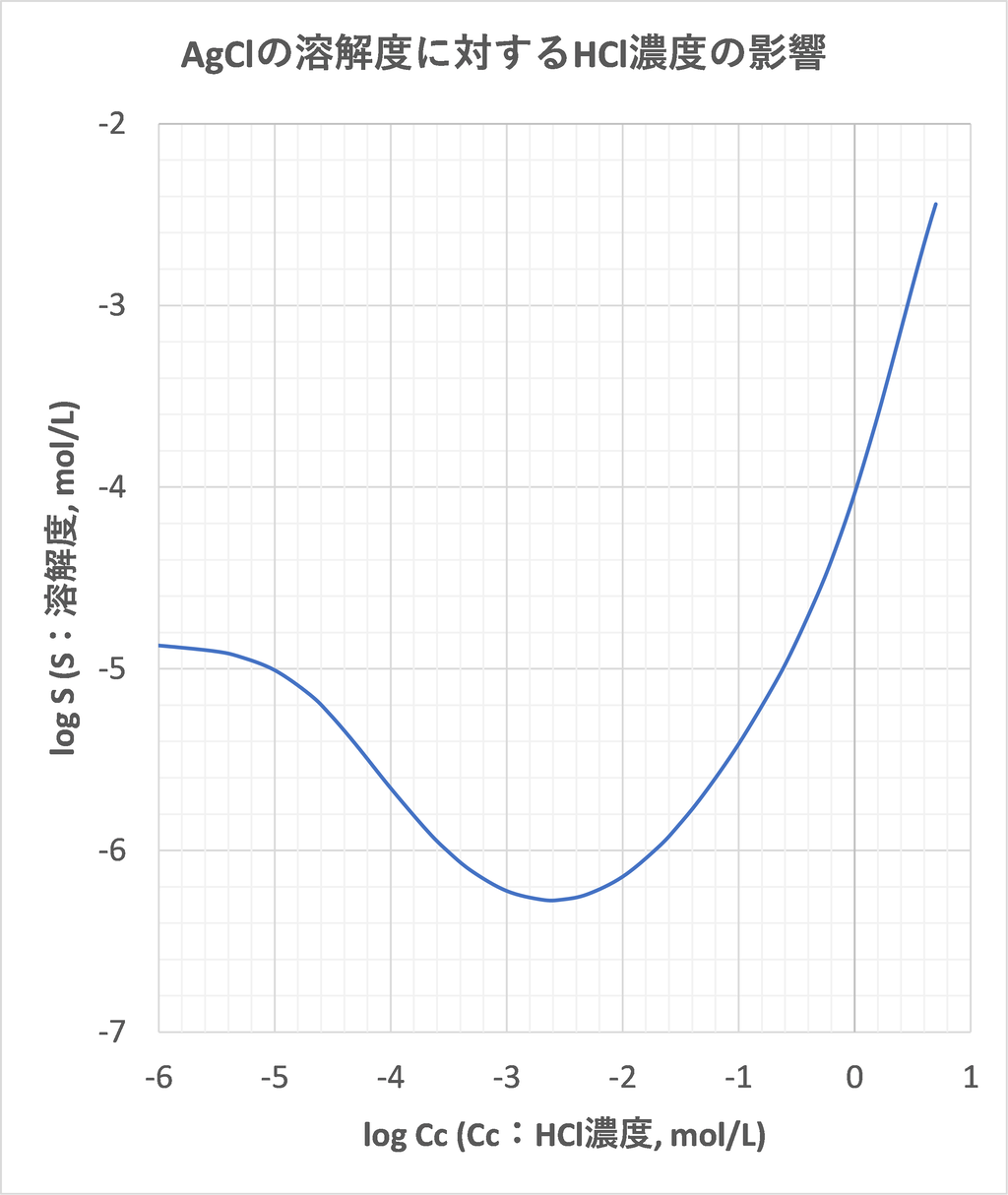
21年08月 滴定曲線 溶解度などーエクセルを用いて
塩化鉛 溶解度積
塩化鉛 溶解度積- Q溶解度と溶解度積 溶解度から溶解度積を求めるにはどうすればいいんでしょうか? 塩化鉛の溶解度30×10ー3mol/L 分子量も与えられてません 塩化鉛の溶解度30×10ー3mol/L 分子量も与えられてません 難溶性塩の溶解平衡、溶解度積と沈殿の生成、分別沈殿 スポンサーリンク 高校理論化学(物質の反応):熱化学、反応速度、化学平衡、酸と塩基 検索用コード 溶解平衡 単位時間に溶解する粒子数と析出する粒子数が等しくなり, 見かけ上溶解




化学講座 第60回 化学反応速度 溶解度積 私立 国公立大学医学部に入ろう ドットコム
3 溶解度積 31 溶解度積とは? 水に溶けにくい電解質である塩化銀\(AgCl\)は飽和水溶液中では1で説明したように次のような溶解平衡が成り立ちます。 \(AgCl(固)⇄Ag^ aq Cl^ aq\) このような溶解平衡に化学平衡の法則を適用すると、 例えばAgCl(下画像)では、Clはハロゲンなので 電気陰性度 が大きく、316である。一方、Agも金属の中では電気陰性度が大きい方で19である。 一般的な塩として 硝酸塩、塩化 PbCl2は熱水に溶ける。これはPbCl 2 が溶解度積平衡(2) 溶解度積 やっぱ、ここでも正確には、銀イオンの活量、塩化物イオンの活量、塩化銀の活量(固体なんで1)で考えれたら楽なんやけど、それはおいといて、 ヨウ化鉛PbI 2 の溶解度積はKsp = 71 x 109 である。PbI 2 の溶解度(mol/L
電気伝導度の測定によると、純水に対するbaso 4 の溶解度は、 25 で105×105 モル/lとなる。 硫酸バリウムの溶解度積を計算せよ。 公式通りの問題ですね。どうしますか?(ii) 塩化鉛 (II) PbCl 2 塩化鉛 (II) PbCl 2 は、熱湯を注ぐか、あるいは沈殿を含む水溶液を加熱すると、沈殿が溶解します。さらに、これにクロム酸イオン CrO 4 2を加えると、黄色沈殿が生成します。これにより、鉛 (II) イオン Pb 2 を確認することができます。溶解度積(ようかいどせき、)または濃度溶解度積(のうどようかいどせき、)とは、難溶性塩の飽和溶液中における、陽イオン濃度と陰イオン濃度の積である。溶解度定数と呼ぶこともある。一般的には、Kspと表す。 は英語の の頭文字である。 溶解度積は温度によって決まる定数であり
可溶性の銀塩水溶液に塩化物を加えると沈殿する白色固体。融点455℃,沸点1550℃。結晶構造は岩塩型で,塩化ナトリウムと同じである。融解すると橙色になる。水に対する溶解度155mg/lH 2 O(℃)。塩酸溶液ではAgCl 2 - を生成して溶解度が増大する。また溶解度0673 0 ,334 110 当サイトについて About Site (株)高純度化学研究所にて取り扱っている電子材料、無機試薬などのうち、特にご利用の多いものについて、WEBにてご提供できるように致しSp);溶解度積 溶解度と溶解度積(1) •難溶性電解質の飽和溶液saturated solution –その溶解度solbilityは、溶液中の陰・陽両イオンの濃度の積で ある溶解度積(Ks)solbility productで表すことができる。 –難溶性電解質B m A n(溶解度;Cs mol/L)はある温度で僅かに




Ksp 溶解度 溶解度積とは Dlouz




金属イオンの分離実験の語呂合わせ 17h29大学入学共通テスト試行調査第1回第2問 問2 A B 語呂合わせで高校化学 大学入試ゴロ化学
塩化銀の溶解度積と銀アンミ 安定度定数の測定 ン錯体の 境 幸夫・安孫子勤・渡辺寛人 (1991年5月30日受理) 1 は じめ に 大学の化学の専門課程では , 分析化学実験を初習実 験として課す例が多い 。 その意義は分析化学実験が化たとえば、塩化銀 AgCl の溶解度積は、式 (2) で与えられる。 Ag +Cl = 18×1010 mol ただし、塩化銀及び臭化銀の溶解度積はそれぞれ18×1010 及び33×1013 とする。 A 沈殿を生ずる塩素及び 臭素 の化学形はCl 及びBr である。これを溶解平衡という。 溶解度の小さいイオン性化合物の溶解度について考えてみよう。例えば,塩化銀を水に溶かすと,極僅か電離して,次の電離平衡が成立する。 AgCl (固) + aq Ag + aq Cl - aq (1) 塩化銀は溶解度が極めて小さい (10 - 5 mol/L) ので解離



Phと金属イオンの溶解度 水浄化フォーラム 科学と技術




溶解度積 塩化カリウム濃度0 05mol L 臭化カリウム濃度0 15m Okwave
臭化鉛(しゅうかなまり、英 Lead(II) bromide )は鉛の臭化物で、化学式PbBr 2 で表される無機化合物である。 臭化物溶液中に硝酸鉛(II)を加えると臭化鉛が沈殿する。 室温では白色の粉末であるが、367℃以上に加熱すると弱い導電性を持つ無色の液体になる。 粉末の状態では水に微溶(0℃の鉛は、天然水中に存在する主な陰イオンにより難水溶性の化合物を形成する傾向にある。 表層水中の溶存態鉛は、pH および水中に溶解している塩に依存する。pH54 を超える場合の 最大水溶解度は、硬水では30 μg/L、軟水では500 μg/Lである。溶解度 水:74g/100ml(℃) (icsc (03)) ghs分類:区分1(心血管系) 一方、塩化水銀の摂取により黄疸、肝酵素の上昇と剖検で肝腫大を認めた35歳の男性、および粉末塩化第二水銀の摂取で、肝腫大が観察された19ヵ月の男児の症例報告(cicad 50 (03))が



2



2 2 3 電離平衡
*塩化銀の溶解度積Ksp=10×1010 回答解説をお硝酸銀による沈殿を用いる積雪中の塩化物 イオン,臭化物イオン及びヨウ化物イオン の蛍光X線 分析法による同時定量 山 本 隆 彦* (1987 年 4 月 13 日受理 ) 塩化物イオン,臭 化物イオン及びヨウ化物イオンそれぞれ05mgカドミウム,鉛は水酸化物法で難溶性の沈殿をつくります。カドミウ ムはpH 12,鉛はpH 8 以上で再溶解します。 カドミウムや鉛の処理水中の濃度は,以下のような溶解度積に基づく 理論溶解度によって計算で求めることが可能です。(75)電 解液への溶解度の小なる鉛化合物の電解還元による大きさ・形状の変化久 野379一 (d)還 元完了の鉛 図2塩 化鉛の形状変化の段階 図2は 塩化鉛の結 晶より鉛への形伏変 化の段階を反射光で 見たもの。 (a)塩 イヒ鉛(b) 硫酸ソーダ水溶液へ の浸漬による




06年京大後期化学の溶解度積の問題です 化学 解決済 16 12 12 教えて Goo




08 2476号 銅含有廃棄物からの高純度銅の回収方法及びそれに用いる溶解液又は電解液 Astamuse
塩化銀と塩化鉛 (Ⅱ)の溶解度を比べると どちらのほうが溶解しやすいのでしょうか? よろしくお願いします。 理由も付けてお願いします。 それぞれの溶解度積は、 25℃において、 AgClは Ag Cl = 10×10^10 (mol/l)^2 PbCl2は Pb2 Cl^2 = 10 ×10^4 (mol/l)^3 ですトピック 公式 C1 C1 C3 C3 および D8 C6 C7 D8 2 物理定数と単位の換算 アボガドロ定数(L またはN A )= 602 × 10 23 mol−1 気体定数(R)= 1 J K−1 mol−1 STPでの理想気体のモル体積 = 227 × 10−2 m3 mol−1 = 227 dm3 mol−1 STPの状態 = 273 K で 100 kPa塩化物イオンの検出には,硝酸銀AgNO 3 水溶液を使いますね。 塩化銀AgClの白色沈殿ができるからです。塩化物の沈殿は,塩化銀と塩化鉛PbCl 2 だけです。 ともに白色沈殿ですが,塩化鉛PbCl 2 は熱湯に溶解します。 ハロゲン化銀のうち,フッ化銀AgFは水に溶けます。




硫化鉛 硫化鉛 Dlouz




共通イオン効果とは何ですか
溶解度積の計算問題 Theme 溶解度積に関する問題 佐賀大学 (13 理工 ) 必要があれば,原子量および定数は以下の値を使うこと。 H=10,O=16,Ca=40 弱酸の塩に関する以下の問いに答えなさい。 計算において,数値は有効数字2桁で答えなさい。 計算問題におい表73 硫化物が沈殿する下限のpHと溶解度積 沈殿する おおよその下限 pH 硫化物 溶解度積 Ksp 1 SnS 1×10−25 2 ZnS 1×10−24 3 CoS 1×10− 3 NiS 1×10−19 4 FeS 1×10−16 4 MnS 1×10−10じめる。溶解度積の差が大きいほど完全に分別する。 塩化ナトリウム溶液にクロム酸カリウム溶液を少量加えておき、硝酸銀溶液を 滴定すると塩化銀はクロム酸銀より難溶(溶解度が小さい)であるから塩化銀が 先に沈殿する。




塩化 物 イオン 沈殿
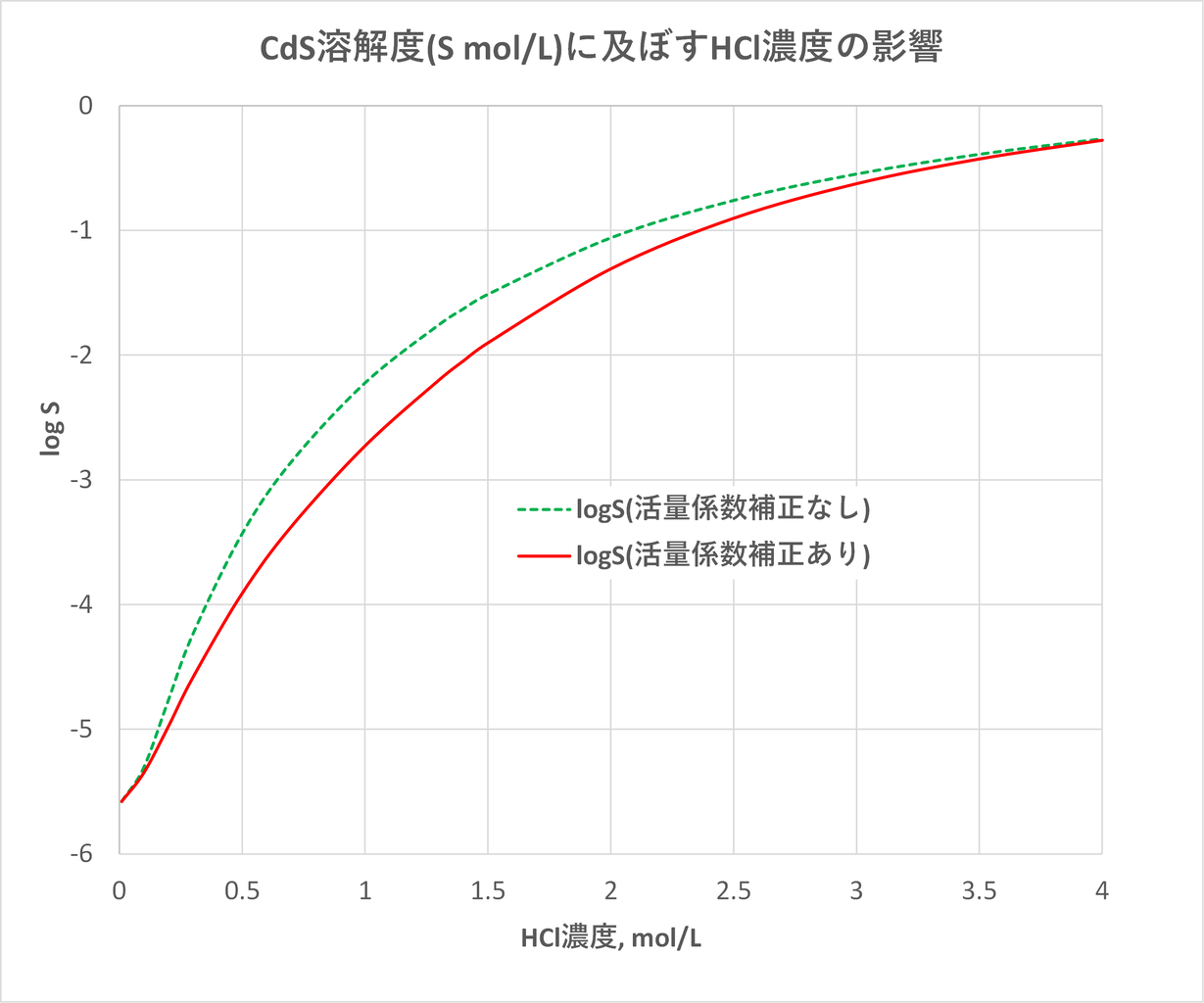



滴定曲線 溶解度などーエクセルを用いて
塩化鉛エンカナマリlead chloride Ⅰ 塩化鉛 (Ⅱ):PbCl 2 ().二塩化鉛ともいう.鉛塩の水溶液に 塩酸 または塩化物水溶液を加えて 白色 の斜方晶系結晶として得られる.密度585 g cm -3 .融点501 ℃,沸点950 ℃. 冷水 ,エタノールなどに難溶, 熱水塩化鉛には感光性がない。 塩化物の反応 塩化銀と塩化鉛はともに白色のため,両者の識別法についてよく狙われる。次の3点をおさえよう! ① 塩化鉛は,高温では溶解度が大きくなり熱水に溶けるが,塩化銀は溶けない。 ② 塩化銀は,過剰のアンモニア水やである。これを,塩化銀の溶解度積 Ksp(AgCl)= Ag +Cl- に代入すると,塩化物イオン(Cl-)の濃度が得られる。塩化物イオン濃度を計算せよ。得られた塩化物イオン濃度を使っ




21年08月 滴定曲線 溶解度などーエクセルを用いて



受験化学 42 溶解度積 みかみの参考書ブログ
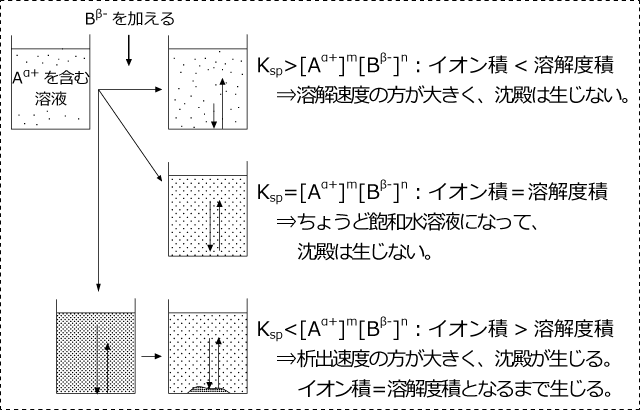
う。溶解度以上に溶質を加えた場合は,溶質の溶解と析出が同時に起こり,しかも その量が等しくなる。これを溶解平衡という。 ここでは,溶解度の小さいイオン性化合物の溶解度について考えてみよう。たと えば,塩化銀を水に溶かすと,ごくわずか 仮の溶解度積が(問題文で与えられている)溶解度積を超えている場合のみ沈殿が生成する。 今回の問題文中にあるAgClの溶解度積は18×1010 (mol/L) 2 で、求めた仮の溶解度積が×1010 (mol/L) 2 なので \Theme 溶解度積に関する問題 愛知教育大学 (10 前記日程 教育 ) 問1 塩化銀の溶解平衡を化学反応式で記せ。 問2 溶解度積K sは水溶液に溶解している物質(分子やイオン)のモル濃度で表すことができる。 塩化銀の溶解度積K



1



2 2 3 電離平衡
ただし、塩化鉛の溶解度積はKsp=Pb2Cl−2=16 × 10^5 (mol/L)^3とする。また、必要であれば、PbCl2の式量は2781、40^(1/2) = 、40^(1/3) = 16として計算すること。 という問題でとりあえず溶解平衡定数を求めたのですが、どのように解くか分かりません。 どなた



カドミウム 鉛 亜鉛 水浄化フォーラム 科学と技術




h30追 再試験センター化学第2問 問5 溶解度積の使い方のコツ 語呂合わせで高校化学 大学入試ゴロ化学



2



無機化学 沈殿生成反応



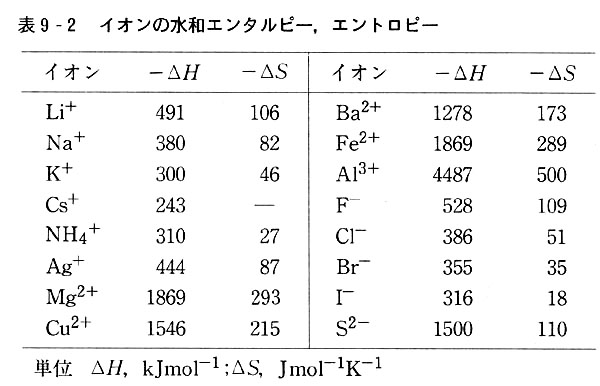
液体の化学テキスト 液体への溶解




溶解平衡 溶解度積 の計算 問題と答え 大学受験の王道



2 2 3 電離平衡




h30追 再試験センター化学第2問 問5 溶解度積の使い方のコツ 語呂合わせで高校化学 大学入試ゴロ化学




h30追 再試験センター化学第2問 問5 溶解度積の使い方のコツ 語呂合わせで高校化学 大学入試ゴロ化学



溶解度積




至急 化学です よろしくお願いします Clearnote




1995 号 半導体装置の製造方法 Astamuse




東北大化学 前期第2問 大学受験in北海道 発展編
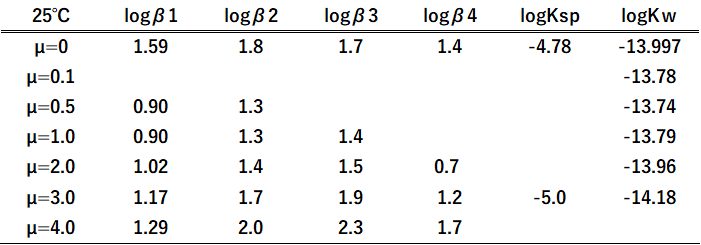



滴定曲線 溶解度などーエクセルを用いて




溶解度積 化学がちょっとだけ好きな社労士



第116章 溶解平衡



化学です 問4の溶解度積の問題なのですが 何故鉛イオン Yahoo 知恵袋




文系が教える理論化学 溶解度積 基本問題 Youtube




あってるかどうかと まちがってたら解説お願いしますm M Clearnote



カドミウム 鉛 亜鉛 水浄化フォーラム 科学と技術




東北大化学 前期第2問 大学受験in北海道 発展編




14 号 電極体 及び当該電極体を備える電池 Astamuse



Pbcl2の溶解度積は1 6 10 5である 塩化鉛の溶解度を Yahoo 知恵袋
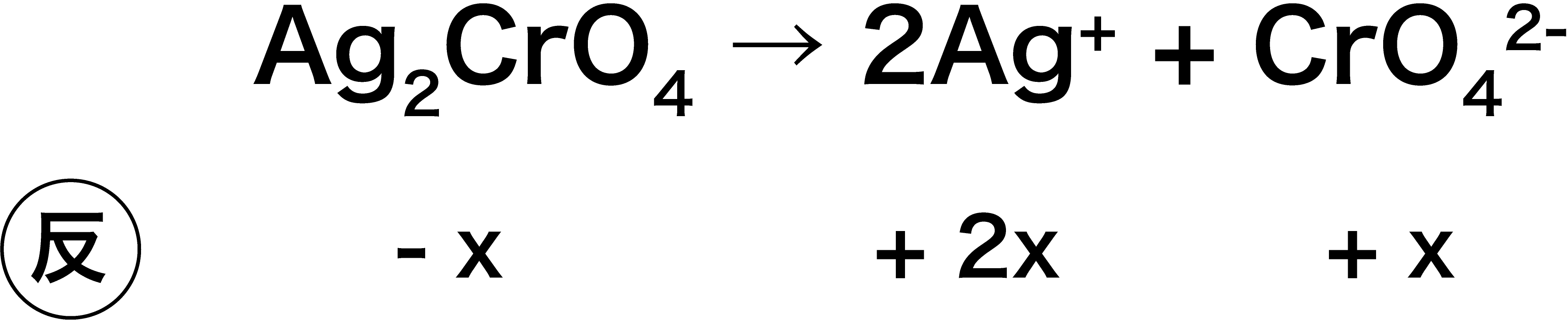



溶解度積 計算問題 単位 溶解度との関係 沈殿生成判定など 化学のグルメ



21年08月 滴定曲線 溶解度などーエクセルを用いて




溶解度積とは 計算方法と入試問題での使い方2パターン 沈殿生成判定のやり方 化学受験テクニック塾




塩化鉛 Wikipedia




05 号 鉛含有金属のライニング方法 Astamuse




問1なのですが解法を見てもさっぱりわかりません なぜcl のモル濃度を求めた Clearnote



1




溶解度積とは 計算方法と入試問題での使い方2パターン 沈殿生成判定のやり方 化学受験テクニック塾




08 2476号 銅含有廃棄物からの高純度銅の回収方法及びそれに用いる溶解液又は電解液 Astamuse



カドミウム 鉛 亜鉛 水浄化フォーラム 科学と技術




風 ディレイ くつろぎ 銀 溶解 温度 R Svc Jp



滴定曲線 溶解度などーエクセルを用いて



Pbcl2の溶解度積をksp Pb2 Ci 2 3 2x10 Yahoo 知恵袋



化学講座 第60回 化学反応速度 溶解度積 私立 国公立大学医学部に入ろう ドットコム



銀イオンと鉛イオンがあって沈殿aは今回塩化鉛なんですが なぜですか Yahoo 知恵袋




沈殿平衡 Yakugaku Lab



2 2 3 電離平衡



3 電解質の溶解と溶解熱




沈殿平衡 溶解度と溶解度積 薬学 これでok



2



Mp Er Eng Hokudai Ac Jp



2




問1なのですが解法を見てもさっぱりわかりません なぜcl のモル濃度を求めた Clearnote




あってるかどうか確認お願いします Clear




02 5080号 正リン酸含有水の脱リン方法及び脱リン装置 Astamuse



2



無機化学 沈殿生成反応



第61章 実験 銀イオンと鉛イオン



2 2 3 電離平衡



第116章 溶解平衡



2 2 3 電離平衡



Phと金属イオンの溶解度 水浄化フォーラム 科学と技術



受験化学 42 溶解度積 みかみの参考書ブログ




化学講座 第60回 化学反応速度 溶解度積 私立 国公立大学医学部に入ろう ドットコム



2



溶解度積って値が大きいほど沈殿が生じにくく 値が小さいほどその値にすぐと Yahoo 知恵袋



2



Pbcl2の溶解度積は1 6 10 5である 塩化鉛の溶解度を Yahoo 知恵袋



無機化学 イオンの系統分離




高校理論化学 難溶性塩の溶解平衡 溶解度積と沈殿の生成 分別沈殿 受験の月



2
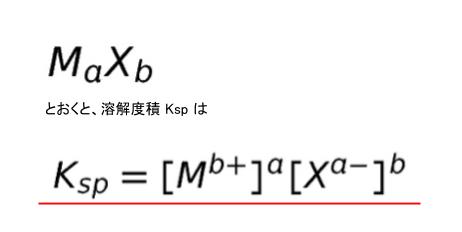



沈殿平衡 溶解度と溶解度積 薬学 これでok



カドミウム 鉛 亜鉛 水浄化フォーラム 科学と技術



受験化学 42 溶解度積 みかみの参考書ブログ




溶解度積とは 計算方法と入試問題での使い方2パターン 沈殿生成判定のやり方 化学受験テクニック塾




問1なのですが解法を見てもさっぱりわかりません なぜcl のモル濃度を求めた Clearnote



カドミウム 鉛 亜鉛 水浄化フォーラム 科学と技術



Pbcl2の溶解度積は1 6 10 5である 塩化鉛の溶解度を Yahoo 知恵袋




15 第2問 問3 溶解度積 化学がちょっとだけ好きな社労士
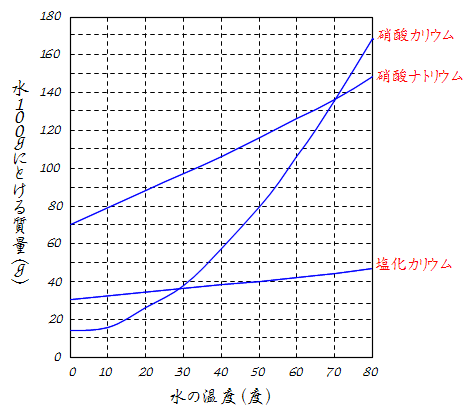



働きアリ 理科



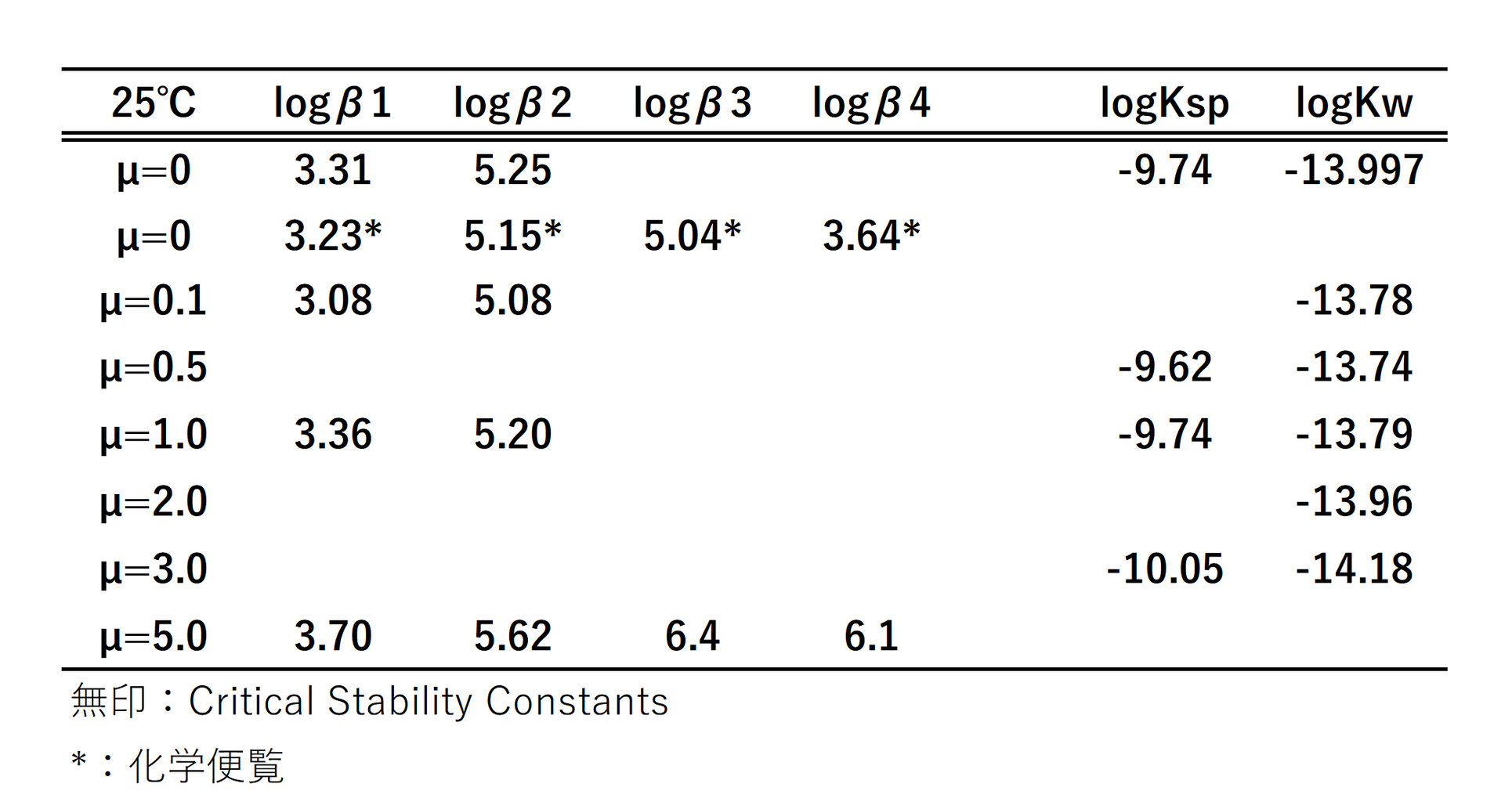
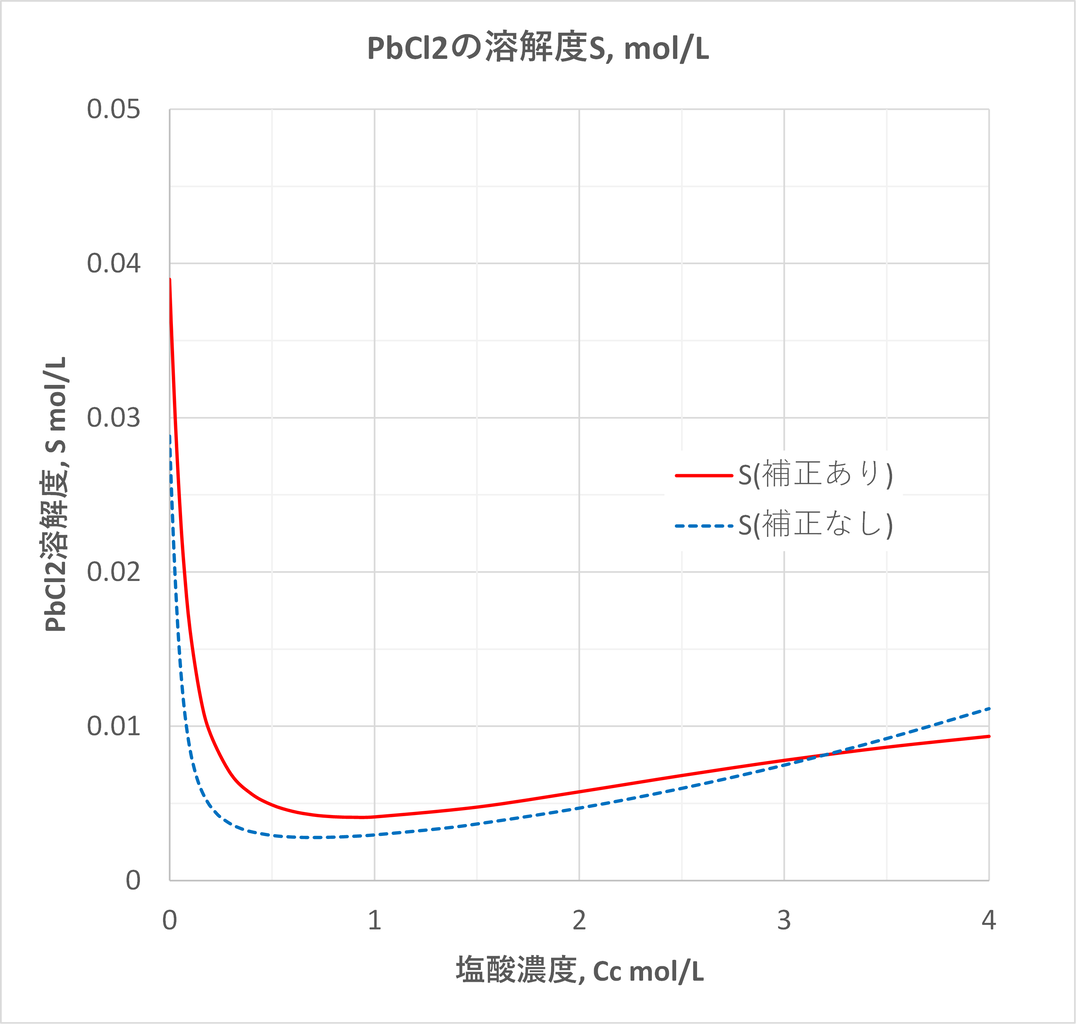
塩化鉛の熱水における溶解度積の文献値を教えていただきたいです Yahoo 知恵袋



第116章 溶解平衡



2



第116章 溶解平衡



2




溶解平衡 溶解度積 の計算 問題と答え 大学受験の王道



2




溶解平衡 溶解度積 の計算 問題と答え 大学受験の王道




溶解度積とは 計算方法と入試問題での使い方2パターン 沈殿生成判定のやり方 化学受験テクニック塾



1



27 94 63 43



塩化鉛の熱水における溶解度積の文献値を教えていただきたいです Yahoo 知恵袋
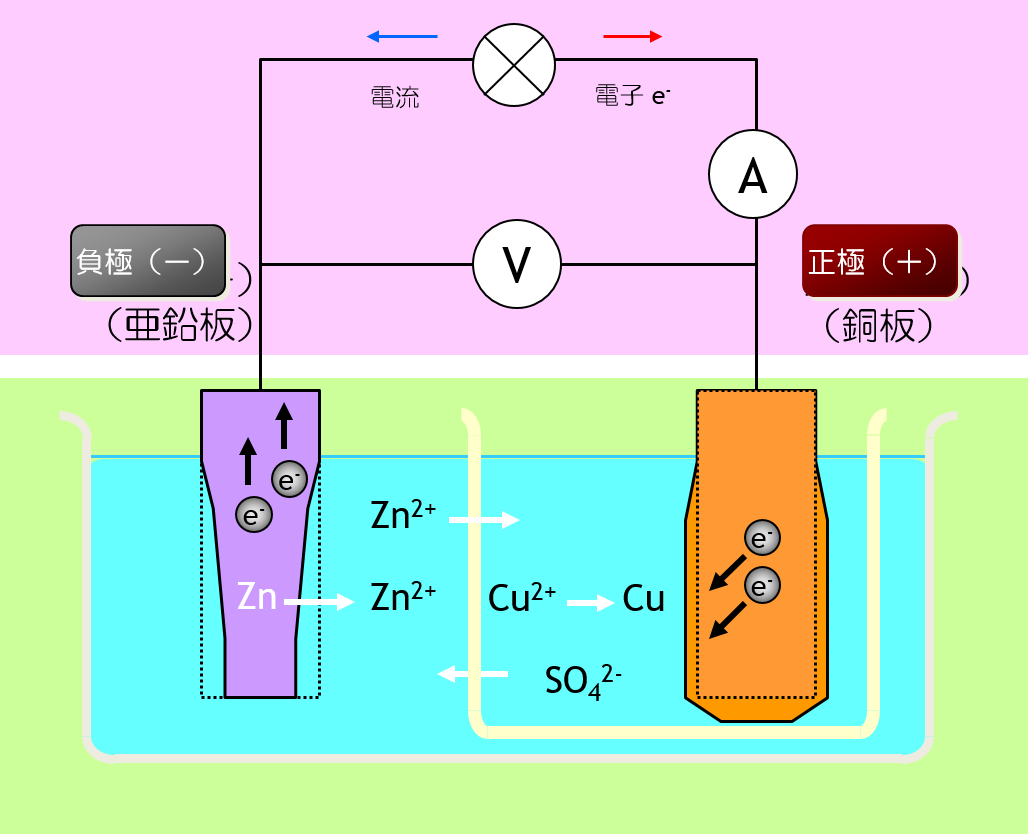



電池の起電力 銀塩化銀電極とネルンストの式




溶解度積とは 計算方法と入試問題での使い方2パターン 沈殿生成判定のやり方 化学受験テクニック塾




東北大化学 前期第2問 大学受験in北海道 発展編



0 件のコメント:
コメントを投稿